
Apa yang dimaksud dengan tekanan osmotik? Bagaimana proses terjadinya? Yuk, sama-sama belajar materi kimia tentang tekanan osmotik dengan membaca artikel ini!
—
Hai, teman-teman! Kamu tahu nggak sih, tekanan osmotik itu sering terjadi dalam kehidupan sehari-hari kita, lho! Salah satu contohnya yaitu peristiwa
berpindahnya air yang terserap dalam tanah menuju
sel akar tanaman.
Bingung, ya? Atau mungkin kamu belum familiar ya, dengan istilah tekanan osmotik?
Apa sih, yang dimaksud dengan tekanan osmotik? B
agaimana proses terjadinya
?
Yuk, baca penjelasannya bersama!
Osmosis dan Tekanan Osmotik
Osmosis adalah peristiwa
difusi
atau perpindahan pelarut dari suatu larutan yang lebih encer atau pelarut murni ke larutan yang lebih pekat melalui membran semipermeabel yang hanya dapat ditembus oleh pelarut tersebut
. Jadi, molekul pelarut akan melewati membran semipermeabel dari larutan yang konsentrasinya rendah menuju larutan yang lebih pekat. Perpindahan ini akan terus terjadi hingga tercapainya
kesetimbangan
.
Dalam sistem osmosis, dikenal larutan hipertonik (larutan yang mempunyai konsentrasi terlarut tinggi), larutan hipotonik (larutan dengan konsentrasi terlarut rendah), dan larutan isotonik (dua larutan yang mempunyai konsentrasi terlarut sama). Nah, dalam proses osmosis, molekul pelarut berpindah dari larutan yang konsentrasinya rendah menuju larutan yang lebih pekat, berarti molekul pelarut berpindah
dari larutan hipotonik ke larutan hipertonik
.
Lalu, apa yang dimaksud dengan tekanan osmotik? Tekanan osmotik adalah
tekanan hidrostatik yang terbentuk dalam larutan yang lebih pekat saat osmosis terjadi
. Tekanan osmotik inilah yang
akan
mempertahankan kesetimbangan osmotik
antara suatu larutan dan pelarut murninya yang dipisahkan oleh membran semipermeabel
. Dengan kata lain, tekanan osmotik adalah tekanan yang diperlukan untuk menghentikan osmosis. Tekanan osmotik ini merupakan salah satu
sifat koligatif larutan
.
Proses Terjadinya Osmosis
Supaya kamu lebih paham, coba perhatikan gambar di bawah ini!
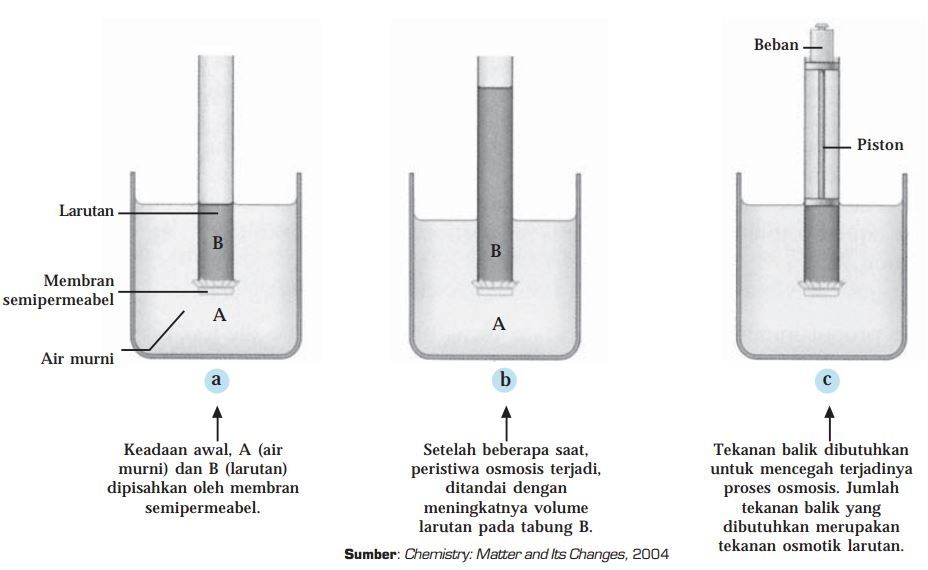
Proses osmosis dengan membran semipermeabel (Sumber: slideshare.net)
Pada gambar tersebut, terdapat dua wadah A dan B. Wadah A diisi dengan air murni, sedangkan wadah B diisi dengan suatu larutan. Keduanya dipisahkan oleh membran semipermeabel yang hanya bisa dilalui oleh molekul air saja.
Gambar (a) menggambarkan kondisi awal. Kemudian, karena konsentrasi larutan B lebih besar, maka akan terjadi proses
osmosis
, di mana air murni akan pindah ke larutan B melewati membran semipermeabel.
Setelah beberapa lama, kondisinya
akan tampak seperti pada gambar (b).
Permukaan larutan B menjadi naik, sedangkan permukaan air murni turun. Nah,
proses osmosis ini terus terjadi dan baru
berhenti
ketika air murni dan larutan B mencapai
kesetimbangan osmotik
.
Nah, kesetimbangan osmotik pada gambar (b) disebabkan oleh tekanan hidrostatik yang terbentuk dalam larutan B saat osmosis terjadi, yang dikenal juga dengan
tekanan osmotik
.
Tekanan osmotik akan
mempertahankan kesetimbangan osmotik
pada larutan A dan B.
Namun, kondisi pada gambar (b) bisa dikembalikan lagi ke keadaan awal seperti pada gambar (a). Caranya adalah dengan memberikan
tekanan luar yang besarnya sama dengan tekanan osmotiknya
, seperti terlihat pada gambar (c).
Baca juga:
Berkenalan dengan Alkohol, Salah Satu Senyawa Turunan Alkana
Nah, setelah memahami apa itu tekanan osmotik, sekarang kita belajar cara menghitungnya yuk!
Menghitung Tekanan Osmotik
Tekanan osmotik dilambangkan dengan tanda π.
Nilai π dari suatu larutan dapat dihitung menggunakan persamaan van’t Hoff seperti berikut.
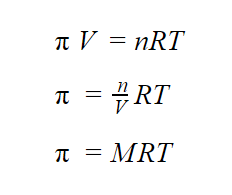
Keterangan:
π = Tekanan osmotik (atm atau Pa)
V
= Volume larutan (L atau dm
³
)
n
= Mol zat terlarut (mol)
R = 0,082 L atm/mol K = 8,314 m³ Pa/mol K
T
= Suhu

Kalau kamu perhatikan dari persamaan penjelasan di atas, terlihat bahwa nilai tekanan osmotik hanya bergantung pada jumlah partikel zat terlarut dalam larutan yang dinyatakan dengan kemolaran larutan. Nah kalau sudah paham, sekarang coba simak contoh soal di bawah ini ya!
Contoh Soal
Berapa tekanan osmotik suatu larutan naftalen (C
10
H
8
) dalam benzena yang mengandung 10 g naftalen per satu liter larutan jika suhu larutannya adalah 15°C?
Pembahasan:
Jumlah mol naftalen:
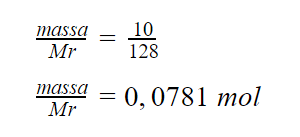
Kemolaran larutan:
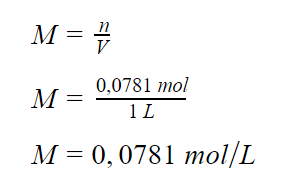
Tekanan osmotik:
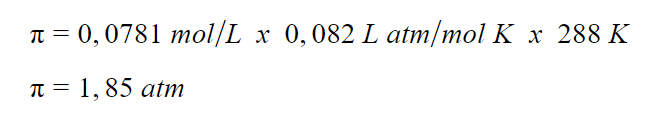
Gimana, teman-teman? Mudah, bukan?
Sekian pembahasan kita mengenai materi tekanan osmotik. Kalau kamu mau menguji kemampuan diri dengan materi lainnya, kamu bisa melakukannya dengan men-
download
ruangbelajar
! Yuk,
download
sekarang!
Artikel ini telah diperbarui pada 18 Agustus 2021.