
Yuk, kenal lebih dekat tentang gas ideal! Apa itu gas ideal? Seperti apa sifat-sifat dan persamaannya? Pelajari selengkapnya dalam artikel berikut, ya!
—
Teman-teman, pernah nggak mendengar istilah
gas
sejati dan gas ideal?
Gas sejati
adalah gas nyata yang ada di sekitar kita. Contohnya yakni gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya.
Gas sejati memiliki sifat dan interaksi yang sangat
kompleks
.
Sementara itu,
gas ideal
adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya, Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, g
as ideal pun memiliki sifat dan interaksi yang
lebih sederhana
dibandingkan gas sejati. Jadi, sederhananya,
gas ideal ini adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Sifat-Sifat Gas Ideal
Salah satu sifat pada gas ideal adalah
partikel-partikelnya tidak memiliki volume
dan
gaya antar partikelnya diabaikan, kecuali tumbukan
.
Gas-gas nyata seperti gas
O
2
, H
2
,
CO
2
, dan gas lainnya, dapat
mendekati sifat gas ideal
ketika berada pada
temperatur tinggi
dan
bertekanan rendah
.
Sifat lain yang dimiliki gas ideal yakni
jarak antarmolekulnya sangat jauh
jika dibandingkan dengan ukuran molekulnya sendiri.
Selain itu, partikel gas ideal
bergerak dengan acak
dan
bertumbukan lenting sempurna
, baik dengan dinding wadah gas atau dengan partikel gas lainnya.
Baca juga:
Pengertian, Penerapan, Rumus, dan Contoh Soal Kapilaritas
Konsep Mol pada Gas Ideal
Untuk menyatakan banyaknya zat pada gas ini, digunakan sebuah besaran yang kita sebut sebagai
jumlah zat
dengan satuan standar internasionalnya adalah
mol
. Dalam 1 mol zat sendiri terdapat
6,022 x 10
23
partikel yang terkandung di dalamnya.

Hukum dan Persamaan Gas Ideal
Pada teori kinetik gas, keadaan gas diuji oleh beberapa ilmuwan dan menghasilkan beberapa temuan sebagai berikut:
1. Hukum Boyle
Hukum Boyle menyatakan bahwa
tekanan gas berbanding terbalik dengan volume gas
, saat temperatur dan jumlah zat gas dijaga tetap konstan.
Secara matematis, hal tersebut dapat dituliskan seperti berikut:
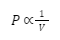
Atau dalam bentuk lain, bisa dituliskan seperti berikut:
PV = konstan
Sehingga, untuk persamaan perbandingan keadaan gas sesuai hukum Boyle, bisa dituliskan seperti berikut:

2. Hukum Charles
Hukum Charles,
menyatakan bahwa
temperatur mutlak dan volume gas akan berbanding lurus
saat
tekanan
dan jumlah zatnya dijaga tetap.
Secara matematis, hal tersebut bisa dituliskan seperti ini:
V ∝ T
Dalam bentuk lain, bisa juga dituliskan seperti ini:
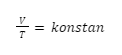
Sehingga, hubungan keadaan awal dan keadaan akhirnya, bisa ditulis seperti rumus berikut ini:

3. Hukum Gay-Lussac
Hukum Gay-Lussac
menyatakan
bahwa
tekanan pada gas berbanding lurus dengan temperatur mutlaknya
, saat gas dijaga dalam volume dan jumlah zat yang tetap.
Secara matematis, hal tersebut dapat dituliskan seperti ini:
P ∝ T
Dalam bentuk lain, bisa dituliskan juga seperti ini:
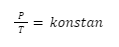
Kemudian, untuk perbandingan keadaan awal dan keadaan akhirnya, bisa dituliskan seperti pada rumus berikut:

Nah, hubungan ketiga besaran makroskopik tersebut, yang terdiri atas tekanan (
P
), volume (
V
), dan temperatur (
T
),
bisa dinyatakan dalam
hukum gabungan gas ideal
, di
mana syaratnya adalah
jumlah zat
harus dalam keadaan
konstan
.
Secara matematis, hal tersebut dapat dituliskan seperti rumus berikut:
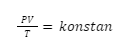
Untuk persamaan keadaan awal dan akhirnya dapat ditulis dengan rumus seperti berikut:
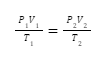
Nah,
sudah paham kan dengan materi hukum dan persamaan gas ideal? Atau masih penasaran? Kalau masih penasaran, yuk pelajari selengkapnya di
ruangbelajar
! Daftarkan dirimu sekarang juga, ya!
Artikel ini telah diperbarui pada 16 Desember 2021.