
Artikel Kimia kelas 10
ini menjelaskan tentang
cara menentukan bilangan oksidasi
disertai dengan contoh soalnya untuk menambah pemahamanmu terhadap materi.
—
Teman-teman, dalam materi reaksi reduksi oksidasi (redoks), kita tahu ya bahwa konsep redoks akan melibatkan 4 hal, yaitu oksigen, hidrogen, elektron, dan perpindahan bilangan oksidasi. Nah, untuk kasus konsep reaksi redoks yang melibatkan bilangan oksidasi, kamu harus paham dulu, nih, apa itu bilangan oksidasi, serta aturan-aturannya.
Di artikel kali ini, kita akan bahas
materi bilangan oksidasi
secara lengkap ya. Mulai dari pengertian,
cara menentukan bilangan oksidasi (biloks)
, dan contohnya untuk meningkatkan pemahaman kamu. Mari kita pelajari bersama!
Konsep Bilangan Oksidasi
Setiap
atom
terdiri dari inti atom dan elektron yang mengelilinginya. Elektron pada kulit terluar atom disebut
elektron valensi
. Apabila atom memiliki elektron valensi berjumlah 8 atau 2, maka atom itu akan bersifat stabil, sehingga sulit untuk berikatan dengan atom lain. Contohnya, seperti atom-atom pada golongan VIIIA
(unsur gas mulia)
. Sementara itu, atom yang tidak memiliki elektron valensi berjumlah 8 atau 2 akan bersifat tidak stabil.
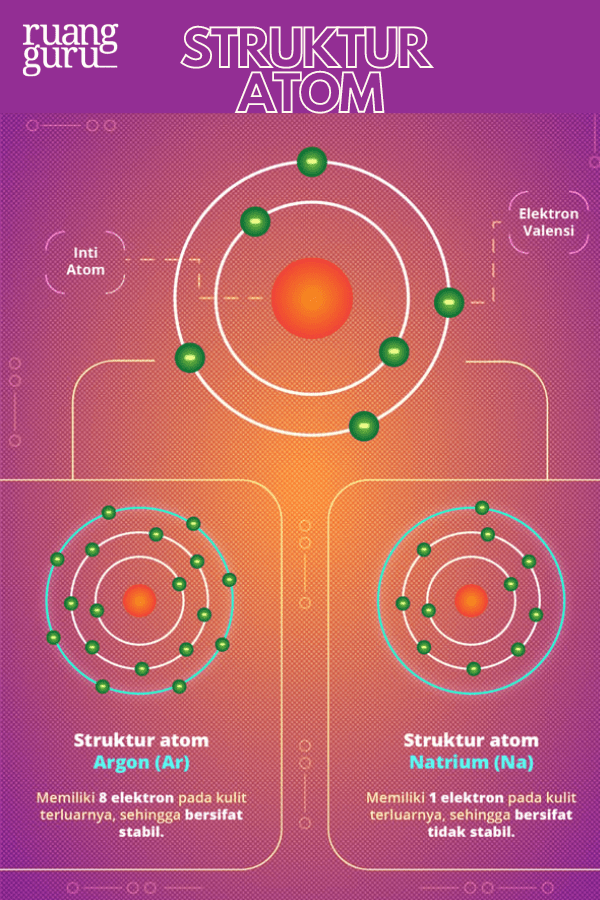
Atom yang sifatnya belum stabil cenderung ingin stabil. Caranya, mereka akan melakukan transfer elektron, yaitu melepaskan atau menerima sejumlah elektron. Akibat dari transfer elektron ini, atom akan memiliki muatan, bisa positif atau negatif.
Atom yang bermuatan
positif
, artinya atom itu telah melakukan
pelepasan elektron
, sehingga kehilangan beberapa elektron yang dimilikinya. Sementara itu, atom yang bermuatan
negatif
, berarti atom itu telah
menerima beberapa elektron
dari atom lain.
Muatan atom berbeda-beda jumlahnya, tergantung dari seberapa banyak elektron yang dilepas atau diterima oleh atom. Nah, jumlah muatan positif dan negatif pada suatu atom bisa kita sebut dengan
bilangan oksidasi (biloks)
.
Pengertian Bilangan Oksidasi
Dengan kata lain,
bilangan oksidasi adalah bilangan yang menyatakan banyaknya jumlah elektron yang diikat atau dilepas oleh atom untuk membentuk ikatan kimia dengan atom lain
. Bilangan oksidasi atau biloks dapat bertanda positif, negatif, atau nol. Berikut ini cara penulisan biloks pada suatu unsur:

Baca Juga:
Konfigurasi Elektron dan Diagram Orbital
Aturan Penentuan Bilangan Oksidasi
Lalu, bagaimana sih cara menentukan bilangan oksidasi (biloks) suatu unsur? Jadi, ada aturannya, nih. Aturan penentuan bilangan oksidasi merupakan urutan prioritas dalam menentukan biloks unsur. Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya:
1. Bilangan oksidasi unsur bebas adalah 0
Unsur bebas
adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul, seperti H
2
, O
2
, Cl
2
, P
4
, S
8
. Semua unsur-unsur tersebut akan memiliki bilangan oksidasi 0.
2. Bilangan oksidasi ion monoatom (1 atom) dan poliatom (lebih dari 1 atom) sesuai dengan jenis muatan ionnya
Contoh:
Bilangan oksidasi ion monoatom Na
+
, Mg
2+
, dan Al
3+
berturut-turut adalah +1, +2, dan +3.
Bilangan oksidasi ion poliatom NH
4
+
, SO
4
2-
, dan PO
4
3-
berturut-turut adalah +1, -2, dan -3.
3. Bilangan oksidasi unsur pada golongan logam IA, IIA, dan IIIA sesuai dengan golongannya
Biloks golongan logam IA = +1
IA = H, Li, Na, K, Rb, Cs, Fr = +1.
Contoh:
Bilangan oksidasi Na dalam senyawa NaCl adalah +1.
Biloks golongan logam IIA = +2
IIA = Be, Mg, Ca, Sr, Ba, Ra = +2.
Contoh:
Bilangan oksidasi Mg dalam senyawa MgSO
2
adalah +2.
Biloks golongan logam IIIA = +3
IIIA = B, Al, Ga, In, Tl = +3
Contoh:
Bilangan oksidasi Al dalam senyawa Al
2
O
3
adalah +3.
4. Bilangan oksidasi unsur golongan transisi (golongan B) lebih dari satu
Contoh:
Bilangan oksidasi Cu = +1 dan +2.
Bilangan oksidasi Au = +1 dan +3.
Bilangan oksidasi Sn = +3 dan +4.
5. Jumlah bilangan oksidasi unsur-unsur yang membentuk ion = jumlah muatannya
Contoh:
NH
4
+
= +1
Biloks H = +1. Atom H memiliki indeks 4, maka biloks H dikalikan dengan indeks H = +4. Karena jumlah muatan NH
4
+
= +1, maka biloks N haruslah -3, agar ketika biloks N dan H dijumlahkan, hasilnya sesuai dengan jumlah muatannya, yaitu +1.
6. Jumlah bilangan oksidasi unsur-unsur yang membentuk senyawa = 0
Contoh:
H
2
O = 0
Biloks H = +1. Atom H memiliki indeks 2, sehingga
biloks H dikalikan dengan indeks H =
+1 x 2 = +2. Agar jumlah biloks H dan O sama dengan 0, maka biloks O harus bernilai -2.
7. Bilangan oksidasi hidrogen (H) bila berikatan dengan logam = -1. Bila H berikatan dengan non-logam = +1
Contoh:
Biloks H dalam AlH
3
= -1.
Bukti:
Atom Al merupakan unsur logam golongan IIIA, sehingga biloks Al = +3.
Ingat aturan biloks poin 6
, jumlah biloks unsur-unsur yang membentuk senyawa = 0. Jadi, apabila biloks Al dan H dijumlahkan, hasilnya harus 0. Agar biloks Al + biloks H = 0, biloks H haruslah -3. Karena atom H memiliki indeks 3, maka biloks H : indeks H = -3 : 3 = -1. Terbukti jika biloks H dalam AlH
3
adalah -1.
8. Bilangan oksidasi oksigen (O) dalam senyawa proksida = -1. Bilangan oksidasi O dalam senyawa non-peroksida = -2
Contoh:
Biloks O dalam BaO
2
= -1.
Bukti:
Atom Ba merupakan unsur logam golongan IIA, sehingga biloks Ba = +2. Jumlah biloks Ba dan biloks O harus 0 (aturan biloks poin 6). Oleh sebab itu, biloks O harus bernilai -2. Karena atom O memiliki indeks 2, jadi biloks O : indeks O = -2 : 2 = -1. Terbukti jika biloks O dalam BaO
2
adalah -1.
Baca Juga:
Mempelajari Konsep Reaksi Reduksi Oksidasi (Redoks)
Gimana, nih, sejauh ini apakah kamu sudah paham mengenai aturan atau cara menentukan bilangan oksidasi suatu unsur? Memang agak bikin pusing, ya. Tapi, kalau kamu rajin berlatih soal, pasti akan mudah paham. Nah, supaya kamu lebih expert lagi, di bawah ini ada beberapa contoh soal biloks yang bisa kamu kerjakan. Yuk, kita bahas bersama!
Contoh Soal Bilangan Oksidasi
Tentukan bilangan oksidasi atom yang dicetak tebal berikut ini!
Fe
2
O
3
Cr
2
O
7
2-
S
2
O
3
2-
Pembahasan:
1.
Fe
2
O
3
Untuk soal poin a, kita diminta untuk menentukan biloks Fe dalam senyawa Fe
2
O
3
. Ingat aturan biloks nomor 6, jumlah biloks unsur-unsur pembentuk senyawa adalah 0. Jadi,
Fe
2
O
3
= 0
Biloks O = -2. Karena atom O memiliki indeks 3, maka biloks O dikalikan dengan indeks O = -2 x 3 = -6. Agar jumlah biloks Fe dan O = 0, maka biloks Fe haruslah bernilai +6. Tapi, karena atom Fe punya indeks 2, maka biloks Fe : indeks Fe = +6 : 2 = +3. Jadi,
biloks Fe
2
= +3
.
2.
Cr
2
O
7
2-
Untuk soal poin b, kita diminta untuk menentukan biloks Cr dalam ion Cr
2
O
7
2-
. Ingat aturan biloks nomor 5, jumlah bilangan oksidasi unsur yang membentuk ion akan sama dengan jumlah muatannya. Jadi, biloks Cr dan O apabila dijumlah, hasilnya harus -2.
Cr
2
O
7
2-
Biloks O = -2. Karena atom O memiliki indeks 7, maka biloks O dikalikan dengan indeks O = -2 x 7 = -14. Agar jumlah biloks Cr dan O = -2, maka biloks Cr harus bernilai +12. Tapi, karena atom Cr punya indeks 2, maka biloks Cr : indeks Cr = +12 : 2 = +6. Jadi,
biloks Cr
2
= +6
.
Oke, semoga setelah mengerjakan dua soal di atas, kamu sudah lumayan paham ya dengan materi cara menentukan bilangan oksidasi. Nah, untuk soal poin c, coba kamu kerjakan sendiri, ya.
Baca Juga:
Apa yang Dimaksud dengan Ikatan Ion?
Selesai sudah materi kita kali ini. Jika ada pertanyaan, kamu bisa cantumkan di kolom komentar, ya. Kamu juga bisa tanyakan lebih lanjut soal-soal yang tidak kamu mengerti serta materi pelajaran yang sulit kamu pahami lewat
roboguru Plus
. Tutor roboguru Plus akan siap membantumu menjawab dan membahas materi yang belum kamu pahami itu via live chat.