Artikel Kimia kelas XI ini membahas mengenai sifat-sifat koloid dan cara pembuatannya.
—
Guys
, pernah kepikiran nggak sih, kenapa ya ketika kita membuka jendela di pagi hari, dan cahaya matahari masuk, terlihat banyak banget debu yang beterbangan? Padahal, sebelum jendela dibuka, nggak ada debu yang terlihat, tuh.
Hmmm,
kok bisa, ya?
Nah, ternyata, itu adalah fenomena sifat dari koloid yang disebut efek tyndall. Wah, emang apa sih koloid itu dan bagaimana sifat-sifatnya? Oke, pertanyaan-pertanyaan tersebut akan kita jawab satu per satu di artikel ini, ya!
Masih ingatkah kamu tentang koloid?
Koloid adalah jenis campuran heterogen yang terbentuk karena adanya dispersi suatu zat ke dalam zat lain yang dicampurkan
. Umumnya, koloid berukuran 1 nm hingga 100 nm. Meskipun koloid termasuk jenis campuran, tapi koloid ini berbeda dengan larutan dan suspensi, ya. Karena itulah, koloid juga punyai sifat khas yang berbeda dari sifat sistem-sistem dispersi lainnya.
Yuk
, kita bahas satu per satu!
Baca Juga:
Mengenal Sistem Koloid dan Jenis-Jenisnya
Macam-Macam Sifat Koloid
1. Efek Tyndall
Sifat koloid yang pertama adalah Efek Tyndall. Efek Tyndall pertama kali ditemukan oleh seorang ilmuwan asal Inggris bernama John Tyndall. Efek Tyndall merupakan
efek penghamburan cahaya oleh partikel koloid
.
Hmm
, maksudnya gimana? Begini guys, ketika ada berkas cahaya diarahkan ke larutan, cahaya tersebut akan diteruskan, sehingga kita nggak bisa melihatnya. Hal ini karena larutan bersifat homogen. Tapi, ketika berkas cahaya diarahkan ke koloid dan suspensi, berkas cahaya akan dihamburkan, sehingga jejaknya dapat terlihat. Contohnya kayak gambar di bawah ini.
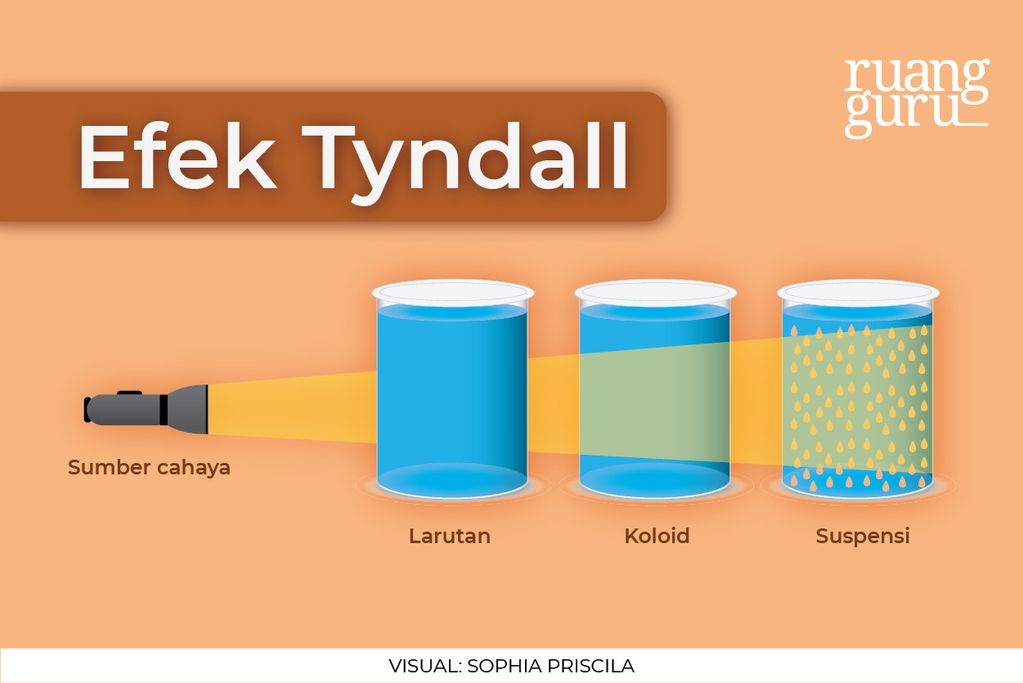
Contoh Efek Tyndall dalam kehidupan sehari-hari, yaitu ketika kita membuka jendela pada siang hari. Saat sinar matahari masuk ke dalam ruangan, maka akan terlihat jelas partikel-partikel debu yang beterbangan.
Hal Ini karena ukuran partikel debu jauh lebih besar daripada panjang gelombang cahaya.
2. Gerak Brown
Pada 1827, seorang botanis asal Skotlandia, Robert Brown, berhasil mengamati gerakan partikel koloid. Ia menemukan, ternyata secara mikroskopis,
partikel-partikel koloid akan bergerak secara acak dengan jalur patah-patah (zig-zag) dalam medium pendispersi
. Nah, gerakan ini disebabkan karena adanya tumbukan antara partikel koloid dengan medium pendispersi.

Partikel koloid yang bergerak secara acak (patah-patah). (sumber: Dg Tito via YouTube)
3. Adsorpsi
Adsorpsi merupakan
peristiwa menempelnya
partikel bermuatan (ion) pada permukaan koloid
. Adsorpsi terjadi karena adanya kemampuan partikel koloid untuk menarik atau ditempeli oleh partikel-partikel kecil. Kemampuan untuk menarik ini disebabkan karena adanya tegangan permukaan koloid yang cukup tinggi.
Misalnya, koloid sol besi (III) hidroksida (Fe(OH)
3
) yang akan bermuatan positif karena mengadsorpsi ion positif. Sol ini dibuat dengan mencampurkan FeCl
3
ke dalam air panas berlebih, sehingga terjadi proses pembentukkan koloid berupa sol hidrat besi (III) oksida atau Fe
2
O
3
.xH
2
O.
FeCl
3
+ xH
2
O → Fe
2
O
3
.xH
2
O
Ketika sol Fe(OH)
3
terbentuk, ternyata tersisa banyak ion Fe
3+
dalam larutan. Ion-ion ini kemudian diserap oleh sol Fe(OH)
3
pada bagian permukaannya, yang membuat sol Fe(OH)
3
kelebihan muatan positif. Jadi, sol Fe(OH)
3
dikenal sebagai koloid bermuatan positif.

Beda lagi dengan sol As
2
S
3
. Jika diletakkan di dalam air, maka sol As
2
S
3
akan bermuatan negatif karena ion yang diadsorpsinya adalah ion yang negatif. Sol As
2
S
3
dibuat dengan mengalirkan H
2
S ke dalam larutan As
2
S
3
. Bentuk reaksinya seperti ini, guys.
As
2
S
3
(aq)+ H
2
S(g) → As
2
S
3
(s) +H
2
S(l)
Sol As
2
S
3
yang terbentuk dalam air ini ternyata mengadsorbsi ion-ion sulfida (S
2
–
) yang membuat sol As
2
S
3
menjadi bermuatan negatif.
4. Koagulasi
Koagulasi adalah proses
rusaknya sistem koloid
yang ditandai dengan
proses penggumpalan akibat terbentuknya partikel-partikel yang lebih besar ukurannya daripada ukuran koloid
(lebih besar dari 100 nm). Koagulasi dapat dipengaruhi oleh pemanasan, pendinginan, penambahan elektrolit, pembusukan, pencampuran koloid yang berbeda muatan, dan elektroforesis. Contoh koagulasi koloid dalam kehidupan sehari-hari, yaitu pada penggumpalan susu yang basi dan telur yang direbus hingga menggumpal atau mengeras bagian putih dan kuningnya.
Oke, guys, itu lah beberapa sifat koloid yang bisa kamu ketahui, ya. Sebenarnya, sifat-sifat khas koloid bukan cuma yang udah dijelaskan di atas aja, ya. Tapi, masih ada elektroforesis, koloid pelindung, dialisis, koloid liofil, dan liofob. Nah, kalo kamu mau tau penjelasan sifat koloid yang lain, kamu bisa tonton materinya di
ruangbelajar
. Sekarang, kita lanjut ke materi berikutnya ya, yaitu cara pembuatan koloid.
Cara Pembuatan Koloid
Pembuatan koloid bisa dilakukan dengan dua cara, yaitu kondensasi dan dispersi. Biar lebih paham, y
uk,
langsung kita simak penjelasannya!

1. Pembuatan koloid dengan cara kondensasi
Pada cara ini, pembuatan dilakukan dengan
menggabungkan partikel kecil atau partikel larutan dengan partikel yang lebih besar
. Secara sederhana, pembuatan ini menggabungkan koloid yang sudah ada dengan partikel kecil yang lainnya. Penggabungan ini bisa dilakukan melalui tiga cara, yaitu reaksi redoks, dekomposisi, dan hidrolisis.
Reaksi redoks
,
merupakan reaksi yang ditandai dengan adanya perubahan bilangan oksidasi. Contohnya, pada pembuatan sol belerang dengan mengalirkan gas H
2
S ke dalam larutan SO
2.
2H
2
S
(g)
+ SO
2(aq)
→ 3S (koloid) +2H
2
O
(I)
Dekomposisi
,
merupakan reaksi penguraian suatu zat menjadi zat yang lebih sederhana. Contohnya, pada pembuatan sol As
2
S
3
dengan mengalirkan gas asam sulfida ke dalam larutan arsenit.
As
2
O
3(aq)
+ 3H
2
S
(g)
→ As
2
S
3(s)
+ 3H
2
O
(l)
Hidrolisis
,
merupakan
reaksi suatu senyawa dengan molekul air untuk menghasilkan sol logam
. Contohnya,
pada pembuatan sol Fe(OH)
3
dengan mencampurkan larutan jenuh FeCl
3
ke dalam air mendidih, dan diaduk hingga larutan berwarna merah kecoklatan.
FeCl
3(aq)
+ 3H
2
O
(I)
→ Fe(OH)
3
(koloid) + 3HCl
(aq)
2. Pembuatan koloid dengan cara dispersi
Cara pembuatan ini terbalik dengan kondensasi, cara dispersi adalah
memecahkan partikel yang besar atau suspensi menjadi partikel kecil atau koloid
. Untuk melakukan pemecahan ini bisa dilakukan dengan 3 cara, yaitu peptisasi, busur bredig, dan mekanik.
Peptisasi
: Pada cara ini, partikel-partikel besar dipecah dengan bantuan zat pemeptisasi (pemecah). Contoh: endapan Al(OH)
3
dipeptisasi oleh AlCl
3
; endapan NiS oleh H
2
S; dan agar-agar dipeptisasi oleh air.
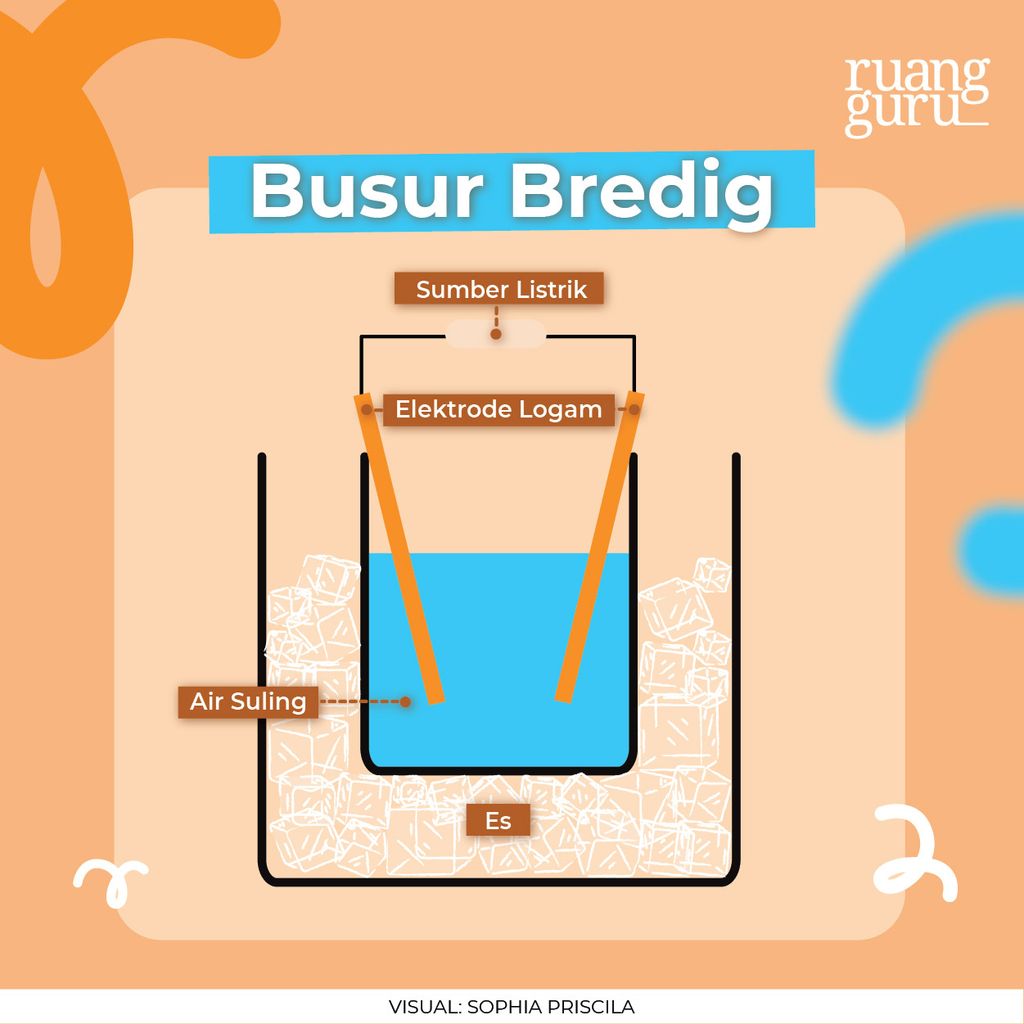
Busur Bredig
: Cara ini digunakan untuk membuat sol-sol logam, seperti Ag, Au, dan Pt. Caranya, arus listrik bertegangan tinggi dialirkan melalui dua buah elektrode logam (bahan terdispersi). Kemudian, kedua elektrode itu dicelupkan ke dalam air, hingga kedua ujung elektrode hampir bersentuhan, agar terjadi loncatan bunga api.
Mekanik
: Pada cara ini, butiran-butiran kasar digerus atau digiling dengan penggiling koloid, hingga tingkat kehalusan tertentu. Lalu, diaduk dalam medium pendispersi. Contoh: sol belerang dapat dibuat dengan menggerus serbuk belerang bersama-sama dengan gula pasir, kemudian serbuk yang sudah halus tersebut dicampur dengan air.
Oke, guys, selesai sudah bahasan kita mengenai sifat dan cara pembuatan koloid. Materi koloid memang sangat asik buat dibahas karena materi ini banyak ditemukan di kehidupan kita. Kalo kamu ingin belajar lebih dalam mengenai materi sistem koloid, kamu bisa banget akses di
ruangbelajar
ya. Sekarang, ruangbelajar punya fitur-fitur baru yang semakin keren dan mempermudah kamu dalam belajar, lho! Buruan download dan nikmati semua fitur-fiturnya.
Referensi:
Dosen Pendidikan. “Sistem koloid:
https://www.dosenpendidikan.co.id/sistem-koloid/
“ . Diakses 08 Juni 2021.
Suwardi, dkk. 2009.
“Panduan Pembelajaran Kimia: Untuk SMA & MA Kelas XI”.
Pusat Kurikulum dan Perbukuan Kemdikbud, Balitbang. CV. Karya Mandiri Nusantara
Video ‘Gerak Brown’ [Daring]. Tautan: https://www.youtube.com/watch?v=9yVhCcQJnC8. (Diakses: 06 Juli 2021)
