
Apa itu laju reaksi? Yuk, kita belajar pengertian laju reaksi beserta faktor-faktor yang memengaruhinya dengan membaca artikel berikut ini!
—
Selain nasi goreng dan sate ayam, makanan apa lagi yang banyak dijajakan di pinggir jalan?
Bubur ayam? Bakso? Mi ayam?
Pasti masih banyak lagi kan? Nah, kali ini kita akan belajar kimia dari abang-abang yang jual makanan dipinggir jalan, tepatnya abang-abang penjual ketoprak. Kamu tau kan, apa itu ketoprak? Ada yang bilang ketoprak itu singkatan dari KEtupat, TOge digePRAK (diulek).
Nah, bumbu ketoprak itu merupakan saus kacang, yang bahan dasarnya dari kacang tanah yang digerus hingga berbentuk bubuk tapi masih agak kasar. Untuk dijadikan bumbu dalam ketoprak, bubuk kacang tersebut diberi pelarut yakni air. Coba kamu perhatikan deh, saat penjual ketoprak menuangkan air ke bubuk kacang tersebut? Apa yang terjadi? Apakah bubuknya tetap menjadi bubuk atau berubah menjadi encer?
Yap, menjadi encer kan? Hal itu karena jumlah dari kepadatan bubuk kacang berkurang karena bertambahnya jumlah air. Nah, banyak lho, yang mengira bahwa hal tersebut merupakan salah satu bentuk laju reaksi. Padahal sebenarnya bukan lho,
guys
!
Laju reaksi itu sendiri merupakan
berkurangnya konsentrasi pereaktan akibat bereaksi
. Kalau di bumbu ketoprak, konsentrasi kepadatan bubuk kacangnya berkurang karena tercampur dengan air atau dalam kata lain karena
pengenceran
, bukan karena reaksi, sehingga tidak bisa disebut sebagai laju reaksi. Laju reaksi itu terjadi jika
konsentrasi pereaktan berkurang akibat bereaksi, bukan karena pengenceran
.
Baca juga:
Jenis-jenis, Reaksi, dan Tetapan Kesetimbangan Kimia
Berarti contoh laju reaksi itu apa, dong? Contohnya antara lain pemakaian bensin pada kendaraan bermotor, pagar besi yang berkarat, pelapukan pada kayu, dan ledakan kembang api.
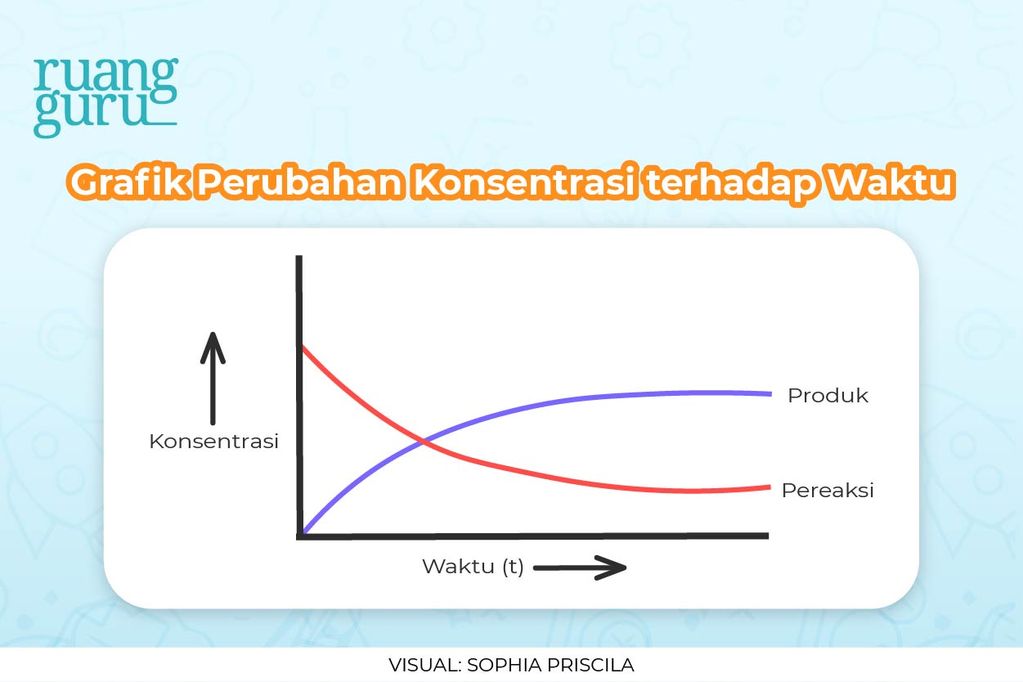
Laju sendiri memiliki kaitan dengan waktu. Nah, apabila waktu yang dibutuhkan itu singkat, maka lajunya besar. Sebaliknya nih, kalau waktu yang dibutuhkan itu panjang, maka laju tersebut kecil. Artinya,
laju berbanding terbalik dengan waktu
.
Contoh reaksi yang berlangsung dengan laju cepat adalah ledakan kembang api. Sedangkan contoh reaksi yang berlangsung dengan laju lambat adalah pelapukan pada kayu dan proses pembentukan karat pada besi.
Persamaan Laju Reaksi
Dalam laju reaksi, umumnya penyebutan satuan dinyatakan dengan
M/s (molaritas per detik)
atau yang disebut juga dengan
molaritas
. Molaritas itu sendiri ialah ukuran yang menyatakan banyak mol zat terlarut dalam satu liter larutannya.
Kamu tahu nggak bahwa laju reaksi juga memiliki persamaan, lho. Persamaan laju reaksi merupakan sebuah persamaan yang memperlihatkan keterkaitan atau
hubungan antara laju reaksi tertentu dengan konsentrasi pereaksinya
.

Baca juga:
Mengenal Energi dan Perubahannya dalam Sistem
Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Orde reaksi ini beda dengan orde lama ataupun orde baru yang ada di mapel sejarah, ya. Orde reaksi itu merupakan
pangkat molaritas dalam persamaan laju reaksi
.
Mudahnya, orde reaksi itu adalah tingkat reaksi.
Orde Reaksi
Orde reaksi menampilkan
hubungan antara perubahan konsentrasi dengan perubahan laju reaksi
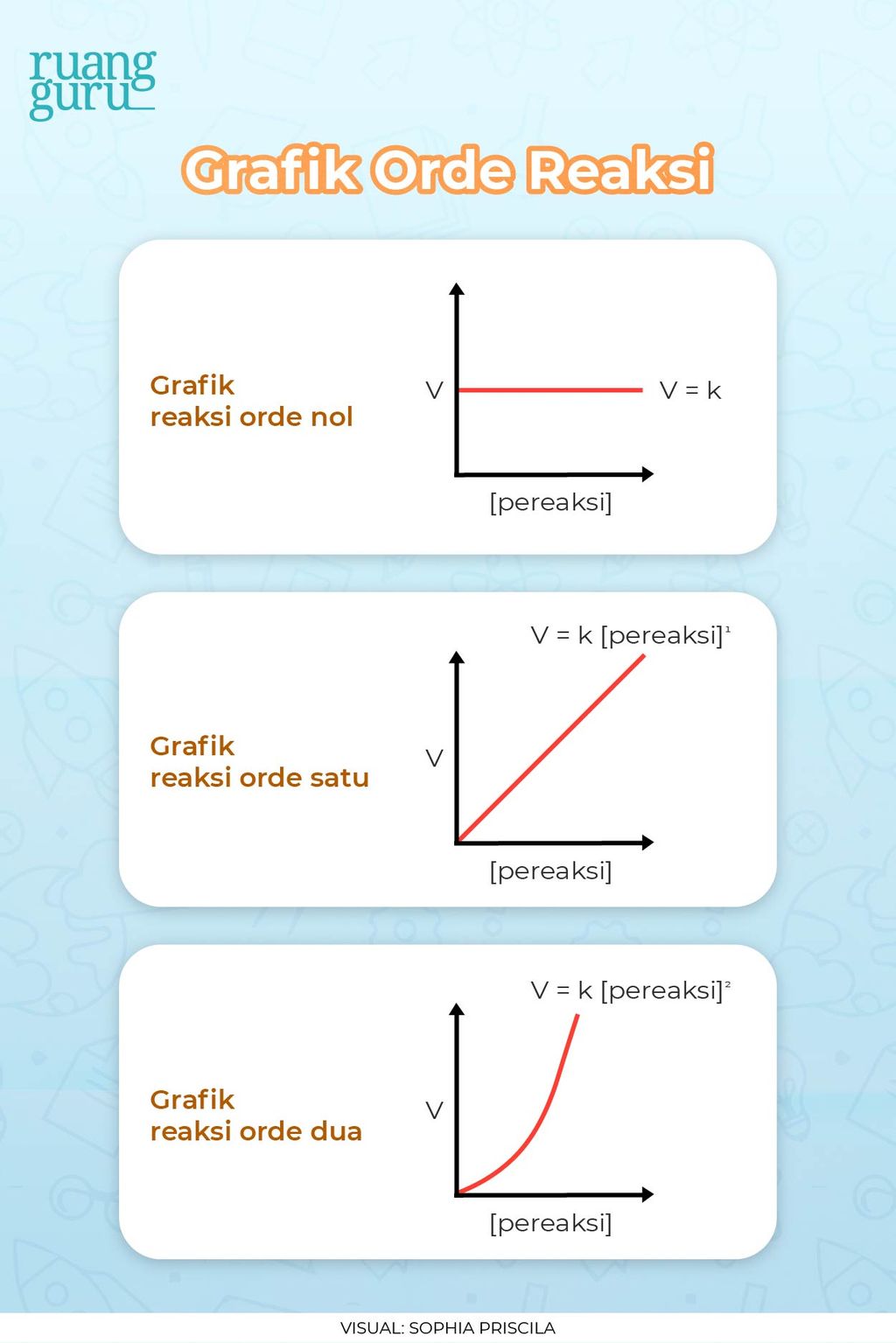
. Nah, hubungan antara keduanya dinyatakan dengan grafik orde reaksi. Ada
tiga macam grafik orde reaksi,
nih. Pertama yaitu
orde reaksi nol
. Grafik ini menunjukkan bahwa laju reaksi tidak bergantung pada konsentrasi reaksi.
Baca juga:
Sifat-Sifat Koloid dan Cara Pembuatannya
Pada grafik
orde satu
, laju reaksi itu punya perbandingan yang lurus dengan konsentrasi pereaksi. Kalau konsentrasi tersebut dinaikkan dua kali, maka laju reaksi juga akan dua kali lebih cepat dari awalnya. Begitu juga seterusnya.
Kalau grafik
orde dua
, ketika konsentrasi dinaikkan n kali maka laju reaksi akan naik n pangkat 2 (n
2
) kali. Contohnya yaitu ketika laju reaksi dinaikkan 2x, maka laju reaksi akan naik 2 pangkat 2 (2
2
) atau 4x lebih cepat dari semula.
Perlu kalian catat nih bahwa orde reaksi itu nggak bisa ditentuin dari bentuk persamaan reaksi. Orde reaksi hanya bisa ditentukan dari
hasil eksperimen
dengan mengubah variabel molaritasnya (reaksi berbentuk larutan dan gas).
Teori Tumbukan
Dalam proses terjadinya reaksi, ada salah satu teori yang bisa menjelaskan tentang hal tersebut, namanya teori tumbukan. Menurut teori ini,
reaksi kimia
yang terjadi itu bisa
terjadi karena partikel-partikel yang saling bertumbukan
.
Kenapa sih, bisa saling bertumbukan?
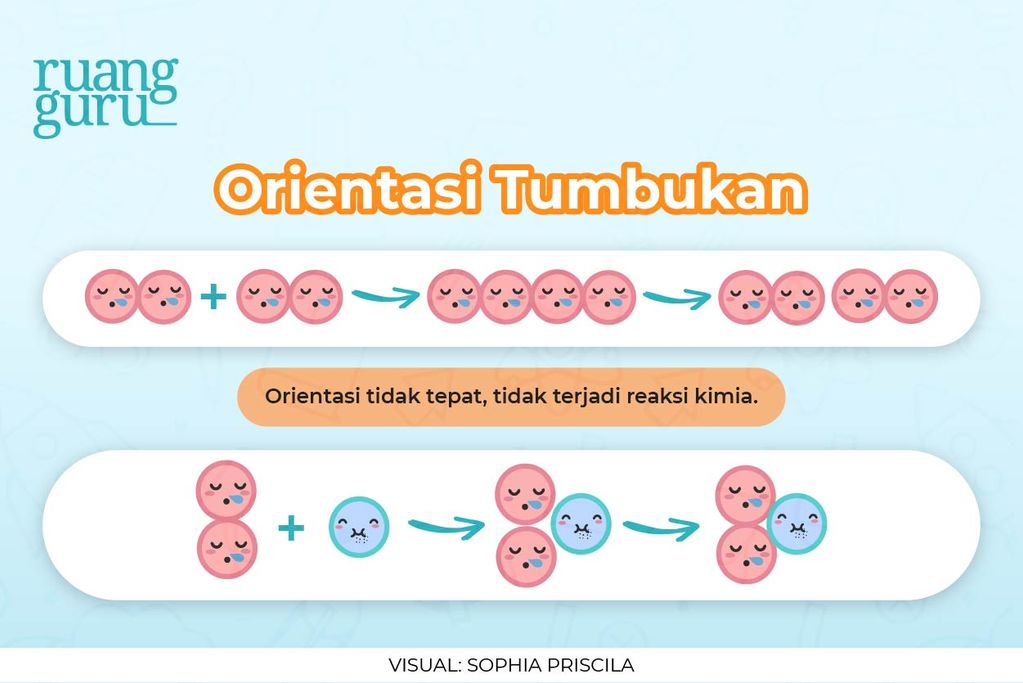
Tumbukan bisa terjadi kalau ada
dua molekul atau lebih
dan
permukaannya saling bersentuhan di satu titik
. Satu titik di sini itu merupakan anggapan bentuk molekul bulat seperti bola. Kamu harus tahu bahwa nggak semua tumbukan bakal menghasilkan reaksi kimia. Tumbukan yang menghasilkan reaksi kimia disebut dengan tumbukan efektif.
Baca juga:
Apa yang Menyebabkan Buah Bisa Matang?
Supaya bisa terjadi tumbukan yang efektif harus ada
orientasi tumbukan molekul yang tepat
. Orientasi sendiri merupakan arah atau letak posisi antarmolekul yang bertumbukan.
Faktor yang Memengaruhi Laju Reaksi
Laju reaksi bisa dipengaruhi oleh beberapa faktor, lho! Faktor-faktor tersebut dapat mempercepat laju reaksi atau malah memperlambat laju reaksi. Faktor-faktor tersebut antara lain
suhu
,
konsentrasi
,
katalisator
, dan
luas permukaan sentuh
. Nah, kita akan bahas beberapa saja, ya.
Konsentrasi
Larutan yang pekat, artinya punya konsentrasi yang besar, punya partikel yang lebih rapat kalau kamu bandingkan sama larutan encer. Nah, dengan kata lain tuh
semakin tinggi konsentrasinya, maka semakin banyak molekul dalam tiap satuan
. Ini berakibat
tumbukan antarmolekul intensitasnya makin sering terjadi dan reaksinya berlangsung semakin cepat
.
Luas Permukaan Sentuh
Jika ada pencampuran reaktan yang terdiri dari dua fasa atau lebih, maka tumbukannya terjadi di bagian permukaan zat. Nah, padatan yang bentuknya serbuk halus, punya luas permukaan bidang sentuh yang lebih besar kalau dibandingkan dengan padatan yang berbentuk lempeng atau butiran. Maka, berlaku bahwa
semakin besar luas permukaan partikelnya, maka frekuensi tumbukan bisa jadi semakin tinggi
. Inilah yang menyebabkan reaksi berlangsung lebih cepat.
Suhu
Reaksi kimia umumnya
lebih cepat jika dilangsungkan pada suhu yang lebih tinggi
. Jika suhunya rendah, maka reaksi kimia akan lebih lambat terjadi. Contoh paling mudahnya yaitu ketika kamu membeli daging sapi potongan. Kira-kira, mana yang lebih cepat membusuk, daging sapi yang dibiarkan di ruangan terbuka atau daging sapi yang disimpan di dalam kulkas (
freezer
)? Coba jawab di kolom komentar, ya!

Baca juga:
Manfaat Minyak Bumi dalam Kehidupan Manusia
Nah, itu tadi penjelasan tentang laju reaksi beserta faktor-faktor yang memengaruhinya. Kalau kamu masih bingung dan ingin mengetahui lebih lanjut tentang materi ini, daftar di
ruangbelajar
deh. Di sana penjelasannya lebih lengkap dan pakai video belajar dengan animasi yang keren. Dijamin makin paham deh. Daftar sekarang juga ya!
Artikel ini telah diperbarui pada 19 Oktober 2021.