
Pernah
enggak sih
RG Squad menghitung berapa lama waktu yang dibutuhkan saat memasak air? Pasti kalian sendiri malas
kan
untuk menghitungnya.
Hmm
lalu bagaimana kondisi air dikatakan telah mendidih itu? Secara visual, air dikatakan mendidih ketika banyak gelembung air yang bergejolak ketika air dipanaskan.
Eits
, tapi ternyata ada prosesnya.Kita bahas
yuk
proses kenaikan titik
didih.

Air yang dipanaskan akan mendidih dan menghasilkan uap air (sumber: doblellave.com)
1. Titik didih (Tb)
Nah
, sebuah zat itu akan mendidih ketika tekanan uap zat cair sama dengan tekanan udara luar. Jadi, titik didih larutan adalah temperatur saat tekanan uap zat cair sama dengan tekanan udara luar. Titik didih yang diukur tanpa memperhitungkan pengaruh tekanan disebut titik didih normal. Titik didih normal ditetapkan berada pada 760 mmHg (≈760 torr), yaitu tekanan rata-rata pada permukaan laut.
Oh iya, jangan heran ya kalau ada perbedaan mengenai simbol titik didih, karena ada yang Tb dan ada yang Td
. Disi ni simbol titik didih yang dipakai adalah Tb dari
boiling
ya, dan kalau versi bahasa Indonesia yaitu Td dari didih.
Baca Juga:
Mengetahui Proses Penurunan Titik Beku
Proses terjadinya pendidihan diawali ketika kita mulai memanaskan sebuah zat. Misalnya,
saat kita memanaskan air, partikel-partikel air akan saling berpisah membentuk uap air
. Proses ini mengakibatkan kenaikan tekanan zat cair. Ketika tekanan zat cair sama dengan tekanan lingkungan luar maka terjadilah peristiwa pendidihan. Pada saat air mencapai temperatur 100º
C,tekanannya menjadi 1 atm (≈760 torr ≈ 760 mmHg ≈ 101.325 Pa), sama dengan tekanan udara di luar. Hal ini menunjukan bahwa titik didih air adalah 100
º
C.
2. Kenaikan titik didih larutan (∆T
b
)
Bagaimana jika ke dalam air ditambahkan zat terlarut misalnya gula pasir? Partikel-partikel gula pasir akan menghambat proses penguapan molekul air sehingga untuk mencapai tekanan uap air sama dengan tekanan udara luar, diperlukan temperatur yang lebih besar lagi. Dengan demikian, apabila ke dalam air ditambahkan zat terlarut maka titik didih larutan akan naik.
Jadi kenaikan titik didih larutan dapat ditentukan sebagai selisih antara titik didih larutan dengan titik didih pelarut
.
∆T
b
= T
b(larutan)
– T
b(pelarut)
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K
b
).
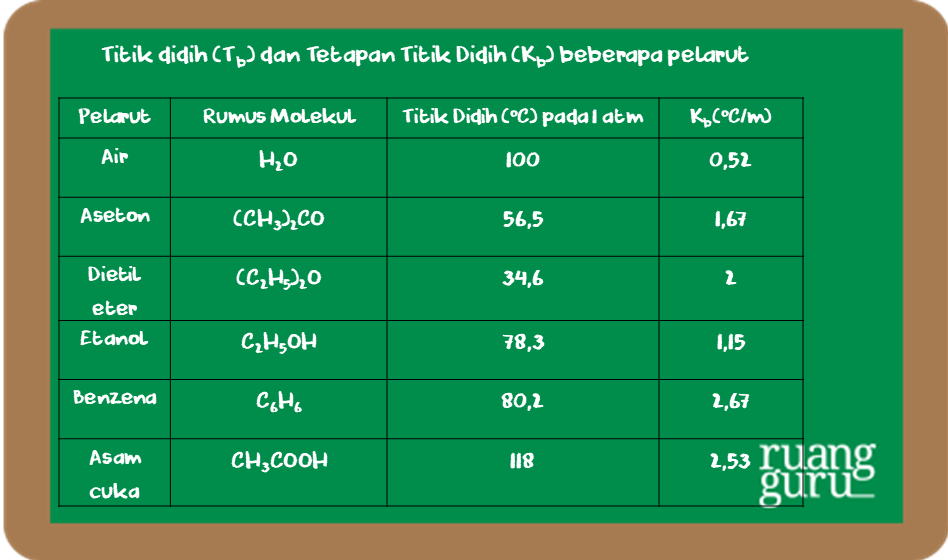
Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah:
∆T
b
= T
b (larutan)
– T
b (pelarut)
∆T
b
= m . K
b
Dengan, ∆ T
b
=kenaikan titik didih
(boiling point elevation)
m
= molalitas
K
b
= tetapan kenaikan titik didih (
o
C kg/mol)
Titik didih melibatkan lebih dari satu fase kondisi atau fase zat terkait (fase cair-gas). Oleh karena itu, akibat penurunan tekanan uap, dapat dijelaskan diagram fase.
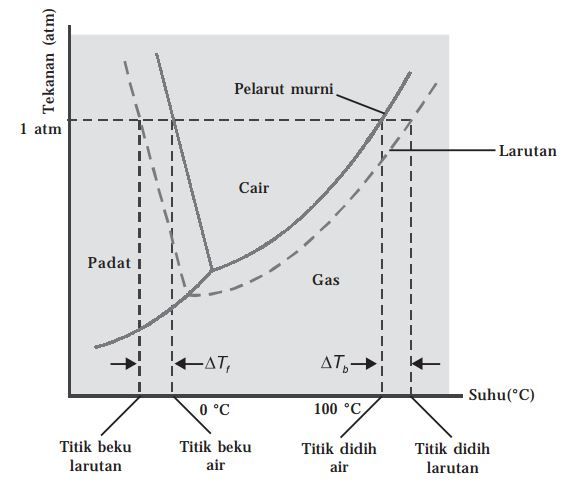
Oke
, sekarang kalian sudah paham
dong
proses kenaikan titik didih.
Nah
, kalau kalian ingin tahu tentang materi Kimia lainya, langsung aja gabung
yuk
di
ruangbelajar
!
Ada video animasi yang keren buat
nemenin
kamu belajar.