
Siapa diantara RG Squad yang gemar makan es batu?
Wah
hampir semua senang es batu ya. Apalagi kalau
pas
lagi siang-siang jam istirahat sekolah, pasti
deh
langsung buru-buru ke kantin buat beli es teh manis.
Di sini, ruangguru punya
informasi buat RG Squad tentang proses penurunan titik beku.
Oke
, artikel ini ada dua pembahasan ya RG Squad. Pertama adalah
Titik Beku
(
T
f
) dan yang kedua adalah
Penurunan Titik Beku Larutan
.

Es batu merupakan hasil proses pembekuan air
(sumber: imgur.com)
1. Titik Beku (T
f
)
Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku (
Tf
) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar
0ºC
, itu artinya tekanan uap air dalam bentuk cair pada temperatur
0ºC
sama dengan tekanan uap air dalam bentuk padat.
Nah,
jika temperatur yang diperoleh saat zat cair dan zat padat berada pada kesetimbangan, (pada 760 mmHg)
disebut dengan titik beku normal
. Oh iya jangan heran kalau ada perbedaan mengenai simbol titik bekuya, karena ada yang Tf dan ada yang Tb. Di sini simbol titik beku yang dipakai adalah Tf dari
‘freezing’
ya, kalau versi bahasa Indonesianya yaitu Tb dari ‘beku’.
2. Penurunan Titik Beku Larutan
Apabila ke dalam sebuah zat pelarut ditambahkan zat terlarut, maka akan terjadi proses penurunan tekanan uap jenuh larutan. Kemudian, adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah.
Baca Juga:
Pengertian Senyawa Polimer
Nah,
berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut dengan titik beku larutan. Besarnya penurunan titik beku larutan diberi lambang ∆T
f
. Harga ∆T
f
ditentukan oleh banyaknya partikel zat terlarut dan tidak ditentukan oleh sifat zat terlarutnya. Nilai ∆T
f
ditentukan berdasarkan rumus Bekmann dan Roult seperti berikut ini.
∆T
f
= T
f (pelarut)
– T
f (larutan)
∆T
f
= m . K
f
Dengan, ∆T
f
= penurunan titik beku (freezing point depression)
m
= molalitas
K
f
= tetapan penurunan titik beku (
º
C kg/mol)
Sebagai acuan dan perbandingan dalam melakukan pengamatan ataupun perhitungan, berikut ditampilkan data tentang titik beku dan nilai K
f
beberapa pelarut.
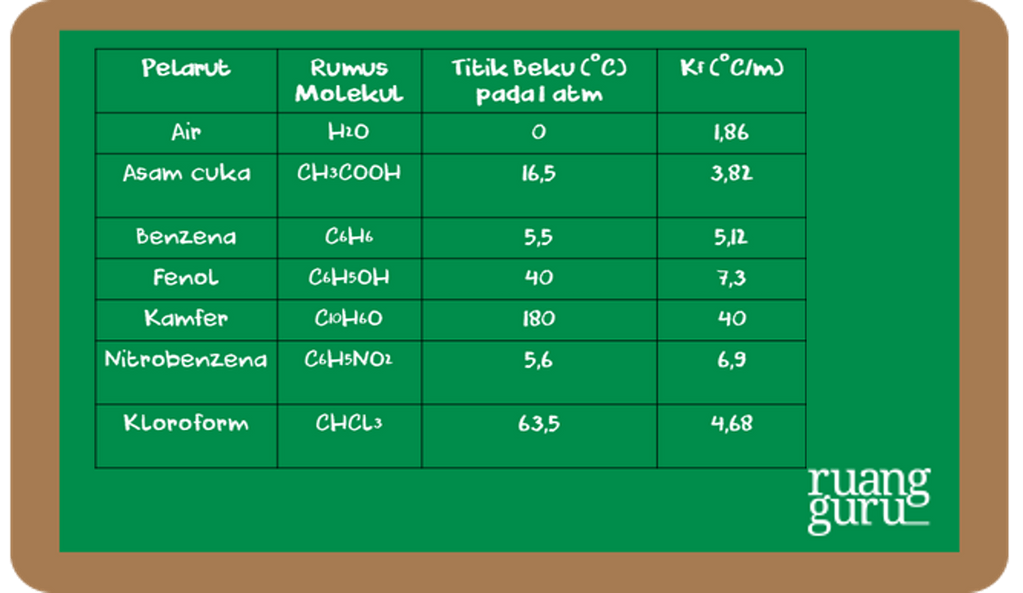
Nilai Kf beberapa pelarut
Bagaimana RG Squad? Kalian sudah paham
kan
bagaimana proses terbentuknya es batu? Di ingat-ingat dan dipahami ya, kalau titik beku itu tercapai ketika temperatur zat cair dan zat padat berada pada tekanan yang sama.
Yuk
, belajar bareng
Master Teacher
dengan video beranimasi yang keren di
ruangbelajar
sekarang!