
RG Squad, ketika kamu mempelajari
ilmu tentang perubahan kalor (panas) suatu zat yang melibatkan proses kimia dan fisika, maka disebut dengan termokimia
. Nah, dari sini kita membutuhkan persamaan termokimia untuk menginformasikan reaksi tersebut khususnya yang terkait jumlah mol reaktan, produk, serta jumlah energi. Namun, tetap harus memperhatikan penulisan koefisien dan fase zatnya. Kenapa? Sebab akan mempengaruhi perubahan entalpi (⧋
H
). Wah, apa
tuh
ya? Kita bahas bersama yuk!
Entalpi adalah banyaknya energi yang dimiliki sistem (
U
) dan kerja (
PV
) sehingga bisa dituliskan
H = U + PV
. Sedangkan perubahan entalpi yaitu kalor reaksi dari suatu reaksi pada tekanan tetap. Supaya entalpi dapat dihitung, maka pengukurannya harus dilakukan pada suhu serta tekanan tertentu. Menurut para kimiawan,
suhu 25°C dan tekanan 1 atm adalah ukuran yang tepat untuk menilai entalpi
.
Suatu perubahan entalpi yang diukur dengan ukuran standar akan disebut perubahan entalpi standar.
Satuannya bernama kilo Joule (kJ) dalam Sistem Internasional (SI)
. Penulisan besarnya entalpi reaksi dalam persamaan reaksi dilakukan dengan dengan menuliskan simbol perubahan entalpi (⧋H) dibelakang persamaan reaksi. Misalnya:
A(s) + B(aq) → C(aq) ⧋
H
= +
x
kJ
Sampai di sini bisa dimengerti, Squad? Sekarang kita lanjut membahas antara termokimia dengan perubahan entalpi ya!
Contoh:
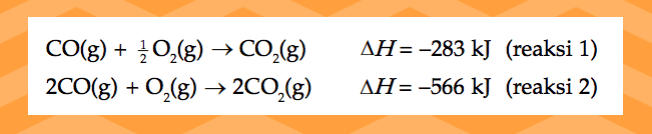
Reaksi 1 merupakan pembakaran 1 mol gas CO dan reaksi 2 merupakan pembakaran 2 mol gas CO dengan ⧋
H
reaksi yang meripakan kelipatan koefisiennya.
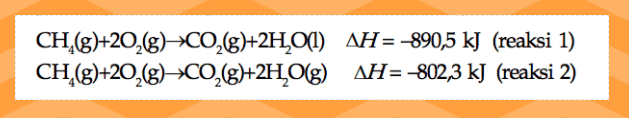

Fase zat yang berbeda akan menghasilkan ⧋
H
yang berbeda pula.
Jenis-jenis Perubahan Entalpi Standar
Ada beberapa jenis perubahan entalpi standar, yaitu:
![]()
Bernama lain kalor pembentukan standar yang merupakan perubahan entalpi ketika 1 mol senyawa terbentuk dari unsur-unsurnya pada kondisi standar.
![]()
Persamaan termokimianya adalah:

![]()
Merupakan perubahan entalpi jika 1 mol suatu zat terbakar sempurna pada kondisi standar.
![]()
Persamaan termokimianya adalah:
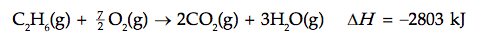
![]()
Dikenal dengan atomisasi unsur yang merupakan perubahan entalpi jika 1 mol berbentuk gas terbentuk dari unsur dalam bentuk fisik pada kondisi standar. Reaksi pengatoman akan memiliki
⧋
H
positif (endoterm). Hal ini dikarenakan reaksi memerlukan energi untuk memisahkan atom-atom.
Contohnya, pengatoman unsur hidrogen. Persamaan termokimianya adalah:

![]()
Merupakan perubahan entalpi jika 1 mol senyawa diubah menjadi atom-atom dalam bentuk gas dalam keadaan standar.
Misalnya pengatoman metana (CH
4
), persamaan termokimianya sebagai berikut:
![]()
![]()
Perubahan entalpi apabila 1 mol senyawa diubah menjadi larutannya pada keadaan standar.
![]()
NaOH(s) → NaOH(aq) ⧋
H
= +50 kJ
![]()
Merupakan perubahan entalpi pada peleburan 1 mol zat padat menjadi zat cair pada titik leburnya dan tekanan standar. Misalnya peleburan es.
![]()
![]()
Perubahan entalpi pada penguapan 1 mol zat cair menjadi gas pada titik didihnya dan tekanan standar. Misal penguapan air dan persamaan termokimianya sebagai berikut:
![]()
Nah, dari banyak contoh yang sudah dijelaskan di atas, masih ada bagian yang belum kamu mengerti, Squad? Tuliskan di kolom komentar ya! Ayo semangat belajar dan pakai
ruangbelajar
untuk membantumu memahami tentang persamaan termokimia dan perubahan entalpi standar ya!