
Sebelumnya RG Squad sudah tahu
kan
pengertian dari sel volta
? Pada sel volta, elektron dirancang untuk mengalir pada rangkaian luar, sehingga dapat menghasilkan kerja. Agar terjadi seperti itu, maka reaksi oksidasinya harus dipisahkan dari reaksi reduksinya, sehingga membentuk sel seperti tampak pada gambar di bawah. Supaya lebih paham coba perhatikan
gambar sel volta
di bawah ini ya.
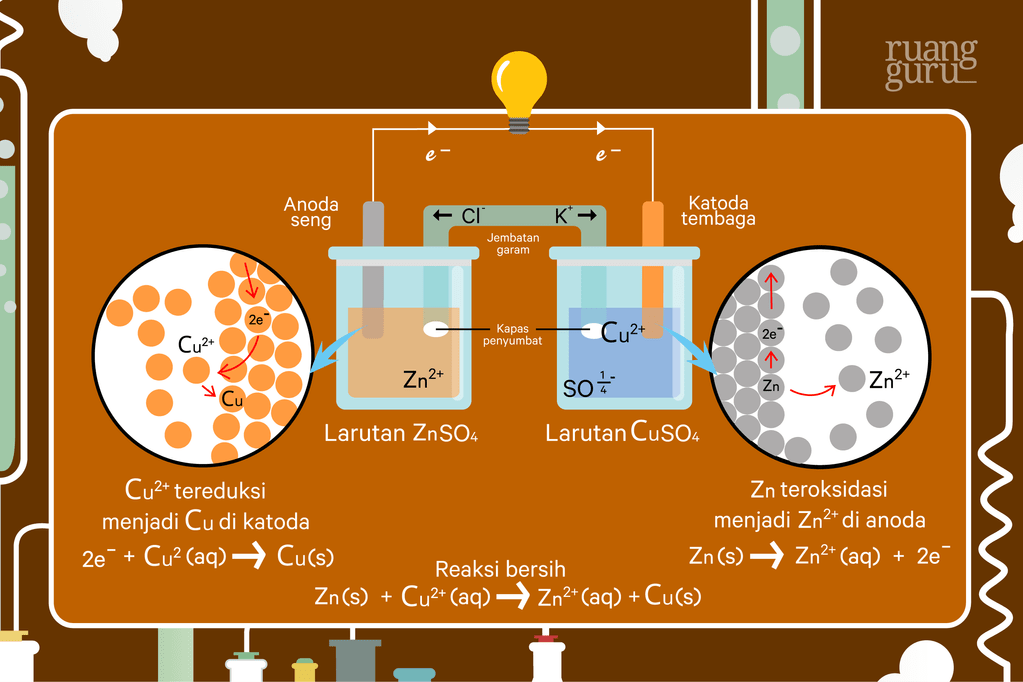
Rangkaian Sel Volta: Kedua larutan dihubungkan oleh jembatan garam yang berisi KCl.
Elektron mengalir dari elektroda Zn (sebagai anoda) ke elektroda Cu (sebagai katoda) melalui kawat eksternal.
Setengah sel yang satu terdiri dari logam seng
(zinc)
yang dicelupkan ke dalam larutan

dan setengah sel yang lainnya terdiri atas logam tembaga
(copper)
yang dicelupkan ke dalam larutan

. Jika kedua elektrodanya dihubungkan dengan rangkaian luar (misalnya kabel, kawat) maka akan dihasilkan arus listrik, yang dapat dibuktikan dengan bergeraknya jarum galvanometer yang dipasang pada rangkaian luar dari sel tersebut, ataupun dengan lampu. Sel yang tampak di
gambar sel volta
di atas, sesuai dengan nama orang yang mengembangkan alat tersebut. Ketika sel volta digunakan sebagai sumber listrik, terjadi perubahan dari Zn menjadi
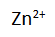
yang sifatnya dapat larut.
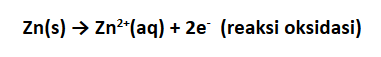
Hal ini dapat diketahui dari semakin berkurangnya massa logam Zn. Di sisi lain, elektroda Cu semakin bertambah massanya karena terjadi pengendapan Cu dari
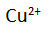
dalam larutan.
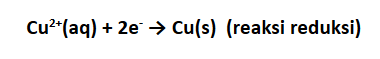
Pada sel tersebut, elektroda Zn bertindak sebagai anoda dan elektroda Cu sebagai katoda. Pada sel elektrokimia, baik sel volta maupun sel elektrolisis, anoda adalah elektroda tempat terjadinya reaksi oksidasi dan katoda adalah tempat terjadinya reaksi reduksi. Untuk memudahkan mengingat perhatikan huruf pertama dari kata katoda dan kata reduksi. Huruf
k
dan
r
sama-sama merupakan huruf konsonan. Sementara huruf pertama dari kata anoda dan oksidasi adalah
a
dan
o
, sama-sama merupakan huruf vokal.
Nah,
agar lebih mudah dalam mengingatnya, bisa dengan menyingkatnya:
KRAO
K
=Katoda,
R
= Reduksi,
A
= Anoda,
O
= Oksidasi
Ketika sel volta digunakan, terjadi arus elektron dari elektroda seng (Zn) ke elektroda tembaga (Cu) pada rangkaian luar. Bisa kita ketahui bahwa dalam fisika ada konvensi yang menyatakan bahwa pada sumber arus, arus listrik mengalir dari kutub positif ke kutub negatif pada rangkaian luar, atau elektron mengalir dari kutub negatif ke kutub positif. Oleh karena itu, logam seng bertindak sebagai kutub negatif dan logam tembaga sebagai kitub positif. Bersamaan dengan itu pula, pada larutan dalam sel tersebut terjadi perpindahan sebagian ion
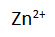
dari kiri ke kanan. Hal ini terjadi karena dalam larutan sebelah kiri terjadi kelebihan ion
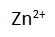
dibandingkan dengan ion
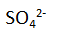
yang ada. Sementara itu, ion
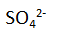
mengalir dari kanan ke kiri karena di sisi kanan kelebihan ion
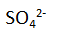
dibandingkan dengan ion
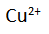
.
Reaksi total yang terjadi pada sel volta adalah:
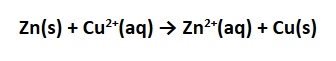

Nah,
itu dia rangkaian sel volta Squad. Sudah paham sekarang kan seperti apa dan bagaimana cara kerja rangkaian sel volta. Jika kalian masih penasaran dan belum paham, bisa banget baca rangkuman dan kerjakan latihan soal di aplikasi
ruangbelajar
. Selamat belajar!