
RG Squad, reaksi-reaksi pada sel elektrolisis yang terjadi ternyata ditentukan oleh beberapa faktor. Kira-kira apa saja ya? Mari kita simak penjelasannya! Selamat membaca dan jangan lupa dipahami.
1. Ion-ion di sekitar elektrode
Pada anode, ion-ion di sekitar anode yang memiliki
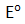
lebih negatif yang akan mengalami oksidasi. Pada katode, ion-ion di sekitar katode yang memiliki
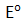
lebih positif yang akan mengalami reduksi.
Contoh:
Pada elektrolisis larutan KI digunakan elektrode grafit. Spesi yang ada di dalamnya adalah ion
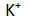
dan
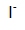
dari hasil ionisaisi KI dan juga ada
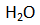
sebagai pelarut (karena larutan). Oleh karena elektrodenya grafit yang inert, elektrodenya tidak mengalami reaksi apapun. Di sekitar anode terdapat
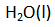
dan ion
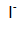
yang akan teroksidasi.
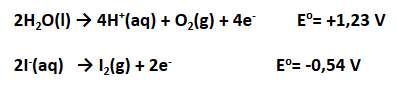
Di sekitar katode terdapat ion
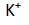
dan
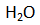
sehingga yang lebih mudah mengalami reduksi adalah atom H pada
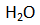
.
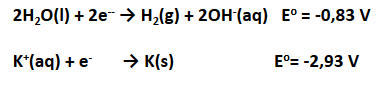
Jadi, pada elektrolisis larutan KI dengan elektrode grafit, reaksi yang terjadi adalah:

Hasil elektrolisis larutan KI adalah gas
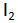
di anode serta larutan KOH dan gas
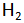
di katode.
Jika di sekitar elektrode tidak reaktif (inert) hanya terdapat jenis zat atau ion, maka zat atau ion tersebut yang mengalami oksidasi atau reduksi.
Baca juga:
Sel Volta dan Rangkaiannya
Contoh:
Elektrolisis lelehan KI dengan elektrode grafit.
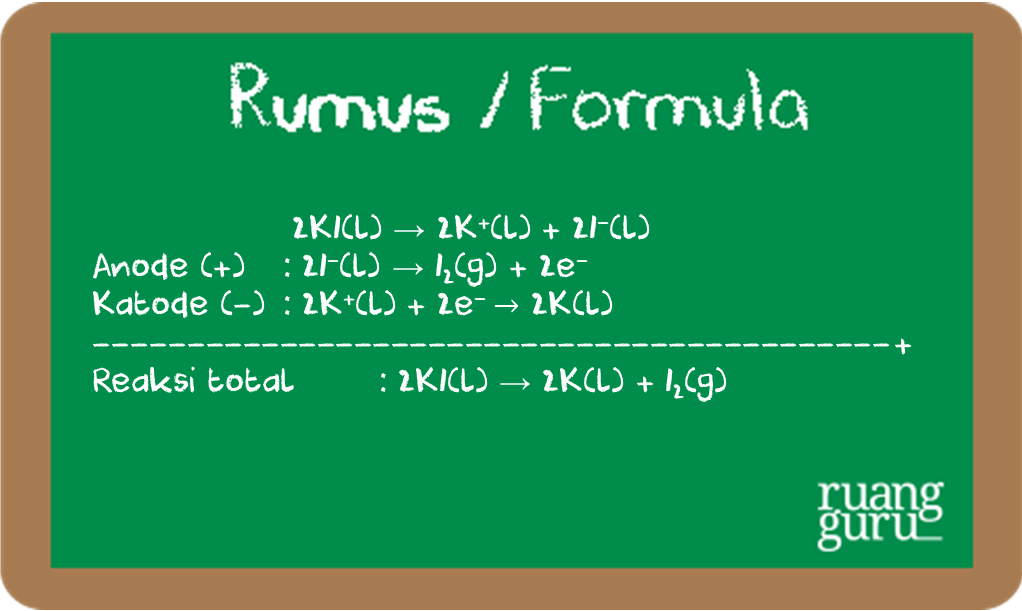
Hasil elektrolsis lelehan KI dengan elektrode grafit adalah gas
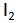
di anode dan logam kalium cair di katode.
2. Bahan elektrode
Jika bahan elektrode terbuat dari grafit (C) atau logam inert (misalnya Pt atau Au), elektrode tidak mengalami oksidasi atau reduksi. Jadi yang mengalami oksidasi dan reduksi adalah spesi-spesi yang ada di sekitar elektrode.
Jika elektrode (terutama anode) berasal darilogam aktif, anode tersebut yang akan mengalami oksidasi.
Contoh:
Kita bandingkan hasil elektrolisis larutan
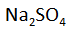
dengan elektrode inert (misalnya grafit, C) dan dengan elektroda reaktif (misalnya Cu).
1. Reaksi elektrolisis larutan
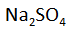
encer dengan elektrode grafit
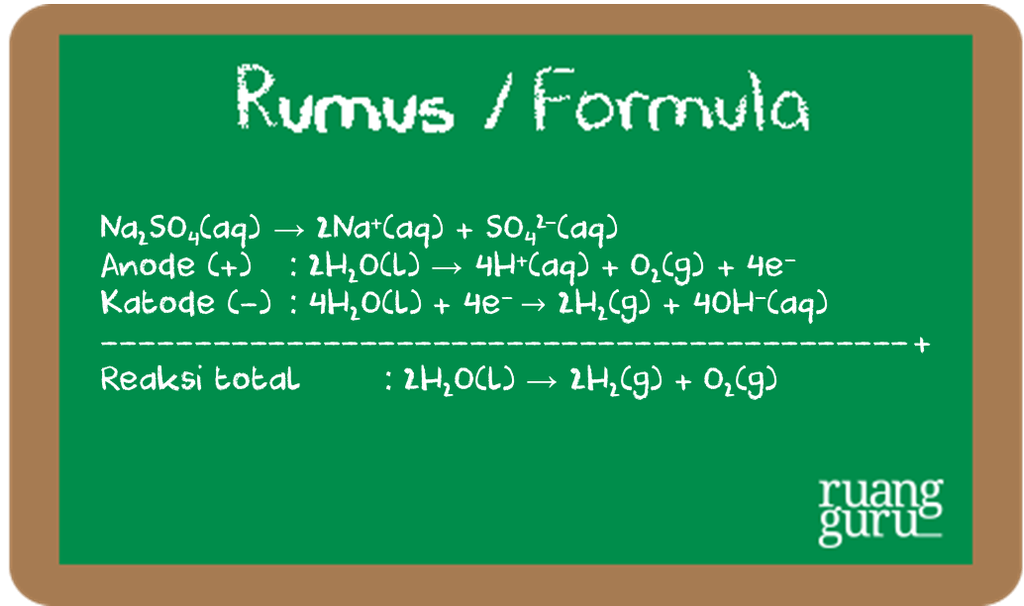
Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode.
2.
Reaksi elektrolisis larutan
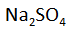
dengan elektrode tembaga.

Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion
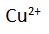
di anode dan gas hidrogen di katode.
Nah,
itu konsep intinya ya, tapi jika ingin lebih ringkas bisa gunakan bagan berikut ini untuk memprediksi reaksi yang akan terjadi pada sel elektrolisis.
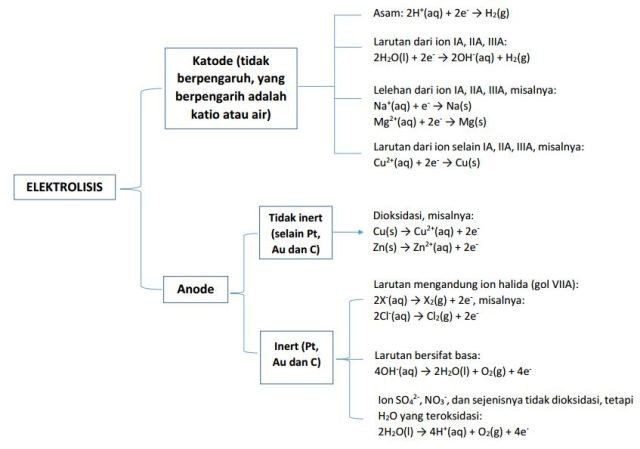
Bagan reaksi elektrolisis
Sekarang kita coba pada contoh soal elektrolisis:
Contoh soal elektrolisis
Tuliskan reaksi elektrolisis berikut!
Larutan
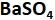
dengan elektrode C
Larutan
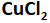
dengan elektrode Au
Penyelesaian:

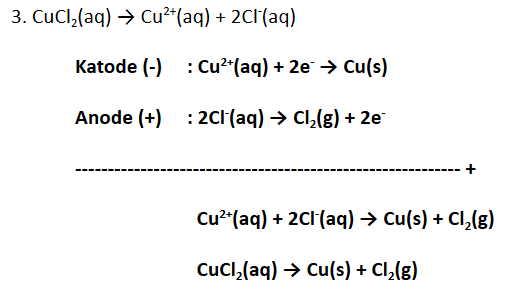
Sekarang kalian sudah paham ‘
kan
tentang reaksi elektrolisis? Selain teorinya, RG Squad juga sudah diberikan beberapa contoh soal. Terus dipahami dan terus berlatih mengerjakan soal ya. Mau mendapatkan rangkuman dan latihan soal lainnya?
Yuk
, coba aplikasi
ruangbelajar
.